Yleistä
Menetelmä soveltuu sellaisten vesien määrittämiseen, jotka eivät
sisällä suuria määriä hapettavia tai pelkistäviä määriä. Jos näyte
sisältää helposti hapettuvia orgaania aineita, potentiometrinen
määritysmenetelmä on parempi.
Määritelmä
Menetelmä tunnetaan Winklerin menetelmänä. Näytteeseen lisätään Mn(II)
ioneja ja liuos tehdään alkaliseksi NaOH:lla, joka sisältää natriumjodidia
(NaI) ja natriumatsidia (NaN3).Näytteeseen liuennut happi
hapettaa muodostuneen valkoisen mangaanihydroksidisakan (Mn(OH)2)
Mangaani (IV) oksidihydroksidiksi (MnO(OH)2). Sakan väri
muuttuu ruskeaksi. Kun näyte tehdään happamaksi, sakka liukenee ja
mangaani muuttuu kahden arvoiseksi. Samalla vapautuu näytteeseen
liuennutta happea vastaava ekvivalenttimäärä jodia, joka titrataan
tiosulfaatilla. Atsidi reagoi nitraatti-ionin kanssa happamessa
liuoksessa:
N3- + H+
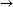 HN3 HN3
HN3 + NO2-
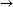 N2
+ N2O + OH- N2
+ N2O + OH-
Reagenssit
Reagensseina käytetään analyysipuhdasta laatua. Puhdistetun veden
sähkönjohtavuuden on oltava < 0,1 µS/cm eikä siinä saa olla yli 45 µm
läpimittaisia hiukkasia.
- Rikkihappo 9 mol/l
Sekoitetaan varovasti yksi tilavuusosa rikkihappoa (tiheys 1,84 g/ml)
yhteen tilavuusosaan vettä litran mittapullossa. Liuos jäähdytetään
huoneenlämpöiseksi.
- Fosforihappo (H3PO4, tiheys 1,71 g/ml)
- Mangaanisulfaattiliuos (MnSO4 4 H2O)
Liuotetaan 480 g mangaani(II) sulfaattia veteen ja laimennetaan
litraksi. Suodata samea liuos.
- Alkalinen jodidiliuos
Liuotetaan seuraavassa järjestyksessä 320 g natriumhydroksidia (NaOH)
500 ml vettä, jäähdytetään ja lisätään samaan liuokseen 600g
natriumjodidia (NaI). Liuotetaan 10g natriumatsidia (NaN3 )
40 ml vettä. Liuokset yhdistetään ja laimennetaan litraksi. HUOM!
Natriumatsidi on herkästi räjähtävää !
- Kaliumjodaattiliuos, 0,002 mol/l
Liuotetaan 428,0±0,1 mg kaliumjodaattia (KIO3, kuivattu
lämpökaapissa) veteen 1000 ml mittapullossa, täytetään merkkiin.
- Tärkkelysliuos, 1%
Lisätään 1g tärkkelystä 100ml vettä, ja kuumennetaan 80-90 asteiseksi.
Sekoita seosta lämmityksen ajan. Kun liuos on kirkas, jäähdytä ja siirrä
indikaattoripulloon.
- Natriumtiosulfaattiliuos, 0,01 mol/l
Liuotetaan 2,48 g natriumtiosulfaattia ( Na2S2O3
5H2O) 500 ml vettä 1000ml mittapullossa, lisätään 0,1 g
vedetöntä natriumkarbonaattia (Na2CO3 )
kestävöintiaineeksi ja laimennetaan merkkiin.
Laitteet ja välineet
- Inkubointipullot
100 300ml:n lasipulloja, joissa hiostulpat tai kierrekorkit.
Hapetuspullot tulisi pestä 2 mol/l suolahapolla hapen määrityksen
jälkeen.
- Byretti
Byretti, jonka asteikko on jaettu 0,05 ml:n väleihin.
Hapen määritys
Näytteenkäsittely
Näytteenotossa on varmistettava, ettei näytteeseen liukene ilman
happea eikä näytteestä poistu happea. Näytteitä, joita analysoida samana
päivänä, säilytetään jääkaapissa ilmatiiviissä astiassa.
- Täytetään näytepullo näytteellä, niin ettei korkin alle jää ilmaa.
- Lisätään 1ml mangaani(II)sulfaattiliuosta heti pinnan alle ja 1ml
alkalista jodidiliuosta pullon pohjalle. Pullo suljetaan korkilla ja
liuos sekoitetaan ja annetaan sakan laskeutua 15 minuuttia.
Näytettä säilytetään tavallisesti viisi tai seitsemän päivää pimeässä
kaapissa huoneenlämpötilassa.
- Näytepullon korkki poistetaan ja lisätään 1ml fosforihappoa näytteen
pintaan. Liuos sekoitetaan jolloin sakan pitäisi liueta. Näyte titrataan
45 minuutin kuluessa hapon lisäyksestä
Titraus
- Tiosulfaattiliuoksen tarkastus
Pipetoidaan 10 ml kaliumjodaattiliuosta titrausastiaan ja lisätään 25 ml
vettä. Lisätään 1ml fosforihappoa ja 1ml alkalista jodidiliuosta. Liuos
titrataan tiosulfaattiliuoksella vaaleaan kellanruskeaan ja lisätään
tärkkelysliuosta indikaattoriksi. Titrataan kunnes liuoksen sininen väri
häviää. Tee kolme rinnakkaismääritystä.
- Näytteen happipitoisuuden määritys
Näyte kaadetaan hapetuspullosta titrausastiaan ja titrataan
tiosulfaatilla vaalean kellanruskeaan.
Lisätään tärkkelys indikaattori ja titrataan kunnes sininen väri häviää.
Tulosten laskeminen
- Tiosulfaattiliuos
A = 6 * 10,0 * C / B, jossa
A = tiosulfaattiliuoksen pitoisuus, mol/l
B = titrauksessa kulunut tiosulfaattiliuoksen tilavuus, ml
C = kaliumjodaattiliuoksen pitoisuus, mol/l
Reaktioyhtälöt:
IO3- + 8I- + 6H+
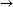 3I3-
+ 3 H2O 3I3-
+ 3 H2O
I3- + 2 S2O32-
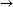 3I-
+ S4O62- 3I-
+ S4O62-
- Lieunneen hapen pitoisuus
C = 8000 * A* B / D, jossa
A = tiosulfaattiliuoksen pitoisuus, mol/l
B = titrauksessa kulunut tiosulfaattiliuoksen tilavuus, ml
C = näytteeseen liuenneen hapen pitoisuus, mg/l
D = näytteen tilavuus
Kerroin 8000 = 1000*32/4 , 1 mooli tiosulfaattia vastaa 8000 mg happea
Suhteellinen virhe % = RSD= 100s/x, jossa
x= keskiarvo
s= keskihajonta
Hapen liukoisuus ilmasta puhtaaseen veteen ( 101,3 kPa, 100% kosteus,
20,0 °C) on 9,08 mg/l.
Etusivu > Ympäristöanalyysit > Liuennut
happi
|
Mittaus-
pöytäkirja
(32 kt Word)
Raportointi-
kaavake
(33 kt Word)
|

