|
|
Palaute Sivukartta |
|
Etusivu
> Analyysimenetelmät
> 4. Mitta-analyysi eli volumetria |
Edellinen | Seuraava | |||
4. Mitta-analyysi eli volumetria |
||||
Mitta-analyysiTitrauksessa määritettävään näyteliuokseen lisätään vähitellen määritettävän aineen kanssa reagoivaa, pitoisuudeltaan tunnettua reagenssia, kunnes reaktio määritettävän aineen ja reagenssin välillä on tapahtunut täydellisesti. Titrauksen päätepiste havaitaan näytteeseen lisätyn indikaattoriaineen värin muutoksesta. Päätepiste voidaan havaita myös esimerkiksi sähkökemiallisin keinoin. Määritettävän aineen määrä voidaan laskea, kun tunnetaan lisätyn reagenssiliuoksen pitoisuus ja tilavuus.Titrausreaktion on täytettävä seuraavat ehdot:
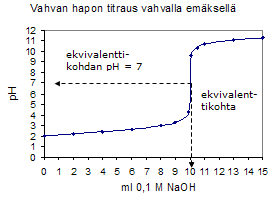
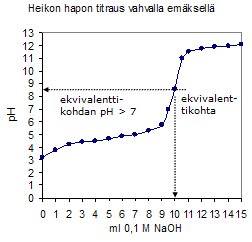
Happo-emästitraus Happo-emästitrauksessa näytteenä olevan hapon tai emäksen määrä selvitetään titraamalla näyte vahvalla emäksellä tai hapolla. Jos esimerkiksi titrataan rikkihapponäyte natriumhydroksidilla, on titrausreaktio seuraava: H2SO4 + 2NaOH = Na2SO4 + 2H2O Koska liuoksen happamuus eli pH muuttuu titrausreaktion aikana, voidaan reaktion päätepiste havaita väri-indikaattorin avulla. Eri väri-indikaattoreilla on kullakin oma värinmuutosalueensa. Kun vahvaa happoa titrataan vahvalla emäksellä, on pH päätepisteessä 7. Kun heikkoa emästä titrataan vahvalla hapolla, pH on päätepisteessä noin 4 – 5. Tällöin sopiva indikaattori on metyylipunainen, joka vaihtaa värinsä keltaisesta punaiseen kyseisellä pH-alueella. Kun heikkoa happoa, esimerkiksi etikkahappoa, titrataan vahvalla emäksellä, sopii indikaattoriksi fenoliftaleiini. Titrausreaktion kulkua voidaan myös seurata pH-mittauksen avulla. Tällöin reaktion päätepiste on pH-muutoksen jyrkimmässä kohdassa.  Kuva 1. Eräiden väri-indikaattorien värien riippuvuus happamuudesta.
Saostustitraus Saostustitrauksessa näyteliuokseen lisätään mittaliuosta, joka muodostaa määritettävän aineen kanssa niukkaliukoisen yhdisteen. Kun määritettävä aine loppuu, titrausliuoksessa olevan yhdisteen määrä näyteliuoksessa lisääntyy, kunnes ylitetään indikaattoriksi lisätyn, hieman liukoisemman yhdisteen liukoisuustulo. Saostustitrauksella määritetään yleisesti esimerkiksi kloridi-ionien määrä näytteessä. Titrausliuoksena on AgNO3-liuos ja indikaattorina käytetään Na2CrO4-liuosta. Kloridi-ionit saostuvat titrauksessa hyvin niukkaliukoisena hopeakloridina. Kun kaikki kloridi-ionit ovat saostuneet, lisääntyy hopeaionien määrä liuoksessa, kunnes alkaa saostua punaista hopeakromaattia, Ag2CrO4. Kompleksometrinen titraus Kompleksometrisessa titrauksessa käytetään standardiliuoksena kompleksoivaa ainetta, joka sitoo määritettävän metalli-ionin kompleksiksi. Indikaattorina on jokin värillinen, heikommin komplekseja muodostava yhdiste. Kun kaikki metalli-ionit ovat sitoutuneet kompleksiksi, alkaa indikaattorina oleva kompleksiyhdiste hajota ja menettää keskusatomejaan vahvemmin kompleksoivalle titrausaineelle, josta on seurauksena indikaattorin värin muutos. Tärkein kompleksometrisissä titrauksissa käytetty kompleksoiva aine on EDTA eli etyleenidiamiinitetraetikkahappo. Hapetus-pelkistystitraus Hapetus-pelkistystitrauksessa hapetetaan (tai pelkistetään) määritettävä aine titrausreagenssilla hapetusasteesta toiseen. Indikaattoreina on monimutkaisia orgaanisia yhdisteitä, joiden hapettuneella ja pelkistyneellä muodolla on eri värit. Ferroiini on tunnetuin indikaattori. Sen väri muuttuu punaisesta siniseen. Siinä on keskusatomina rauta joko kahden- tai kolmenarvoisena. Hapetus-pelkistystitrauksiin kuuluvat cerimetrinen, jodometrinen ja permanganaattititraus.
Kirjallisuus
|
||||
| Etusivu > Analyysimenetelmät > 4. Mitta-analyysi eli volumetria |
Edellinen | Seuraava | |||