|
Korroosioparit
ja niiden toiminta
Korroosio perustuu korroosioparien eli galvaanisten paikallisparien
toimivuuteen. Käytännössä korroosiota tapahtuu
sähkökemiallisina liukenemisreaktioina olosuhteissa, joissa
vettä on läsnä. Tällöin korroosioparin
epäjalompi (liukenemisalttiimpi) metalli tai samankin metallin
epäjalompi osa (termodynaamisesti enemmän energiaa
sisältävä) pyrkii liukenemaan, ja jalompi osa pysyy
suojattuna. Kuva 1 esittää klassista
rauta-kupari-korroosioparia suolaliuoksessa.
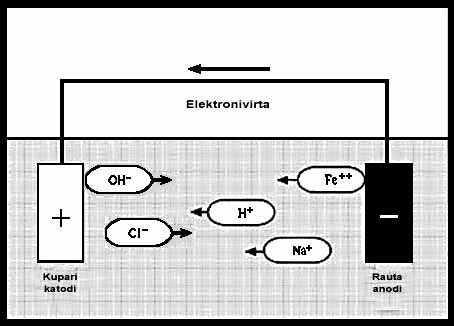
Kuva 1. Galvaaninen
korroosiopari rauta-kupari suolaliuoksessa.
Rauta (teräs) ja kuparielektrodi ovat sähköä johtavassa suolaliuoksessa (ruokasuola NaCl + vesi H2O)
eli elektrolyytissä. Kupari on jalompana katodi ja rauta
epäjalompana anodi eli syöpyvä elektrodi, josta liukenee
ferroioneja (Fe2+). Elektrodit on yhdistetty toisiinsa
johtimella, ja elektrolyytissä ionit (H+, OH–, Na+,
Cl–) huolehtivat sähkövirran kuljetuksesta.
Erot kappaleen eri osien potentiaaleissa johtuvat muun muassa seuraavista seikoista:
-
Metallin rakenteen epähomogeenisuudesta, joka
teräksessä on jo rakenteesta johtuen tavanomaista; koostuuhan
teräs yleensä ferriitistä, perliitistä ja
erilaisista karbideista, joiden jakautuma saattaa vaihdella.
Seosaineiden mukaantulo vielä lisää mahdollisuutta
eroihin. Rakenteen eri osien muokkaus jättää pintaan
erilaisia energiatiloja, samoin lämpökäsittelyt
erilaisina eri osille.
-
Upotuksessa syntyneen pintakalvon (kaksoiskerros)
rikkoutumisesta hankauksien, virtauksien tms. vaikutuksesta tai
vedenalaiseen pintaan saostuneista vieraista aineosasista, jotka ovat
joko peräisin vedestä itsestään tai muodostuneet
korroosiotuotteista.
-
Rakenteiden valmistukseen tai käyttöön liittyvistä jännitystiloista.
Korroosioreaktio eli
raudan (teräksen) liukeneminen vedessä tapahtuu
yleensä seuraavasti:
anodireaktio 2Fe°
= 2Fe2+
+ 4e-
(1)
katodireaktio H2O
+ O2
+ 4e-
= 4 OH - (2)
joka näkyy liuoksen alkalisuutena (OH-ioneja runsaasti) eli pH-arvo nousee.
Liuoksessa liuennut rauta
ja hydroksyyli-ioni reagoivat edelleen ruosteeksi
2Fe2+
+ 4OH-
= Fe(OH)2
(3)
jolloin kokonaisreaktiona
(1) + (2) + (3) = (4)
Fe° + H20
+ 1/2 O2
= Fe (OH)2
(4)
Muodostunut
ferrohydroksidi muodostaa liuoksessa olevan hapen kanssa ruskeaa
ruostetta:
4Fe(OH)2
+ O2
> 4FeOOH + 2H2O
(5)
tai edelleen
Fe(OH)2
+ 2FeOOH > Fe3O4
+ 2H2O
(6)
Korroosion tapahtumisen ehtoina ovat reaktion kineettiset edellytykset. Seuraavien tekijöiden on siis toteuduttava:
-
Metallien tai jopa metallin eri osien välillä on
jännite-ero, joka toimii kyseisen korroosioreaktion ajavana
sähkömotorisena voimana (emf). Voiman on oltava
riittävän suuri, jotta reaktio pääsee alkuun; sen
ylläpitämiseen riittää pienempikin energia
-
Metallit ovat sähköisessä kosketuksessa
toisiinsa joko suoraan tai sähköisen johtimen
välityksellä.
-
Metallikappaleet ovat sähköä johtavassa
liuoksessa eli elektrolyytissä, joka on siten
korroosioympäristönä. Tällaiseksi elektrolyytiksi
riittää ilmasta tiivistyvä kosteuskalvo
-
Happea on saatavilla.
Korroosioympäristö
eli rasitusluokat
Metallien korroosionopeus riippuu ratkaisevasti
ympäristöstä, jossa metallinen rakenne on.
Ilmastollisessa korroosiossa määräävänä
tekijänä on aika, jonka metalli on kosteana. Tämä
taas riippuu ilman suhteellisesta kosteudesta.
Käytännössä jo suhteellisen kosteuden arvolla 55 %
metallipintaan tiivistyy vettä ja korroosio alkaa.
Suhteellisen kosteuden arvoon vaikuttaa oleellisesti
lämpötila, joka sekin vaikuttaa merkittävästi
korroosioreaktioiden nopeuteen. Reaktionopeus kaksinkertaistuu aina 10
°C:n välein. Pakkasella ei tapahdu korroosioreaktioita.
Konepajaolosuhteissa joudutaan kylminä vuodenaikoina
erityisesti korroosiovaaraan. Kun kylmät metallikappaleet tuodaan
ulkoa sisätiloihin, ne ovat pitkään
ympäristöään kylmempiä, ja niiden pintaan
tiivistyy kosteutta. Siksi niitä ei voi käsitellä ilman
korroosiovaaraa, ennen kuin ne lämpenevät.
Ilmasta tiivistyvän veden syövyttävyyttä
lisäävät siinä olevat epäpuhtaudet.
Näitä ovat savukaasuista peräisin olevat rikkiyhdisteet
(rikkihappo) ja merivedestä roiskeina ilmaan tulevat suolat
(kloridit).
Korroosioympäristön aiheuttaman korroosiorasituksen
voimakkuus ilmaistaan rasitusluokkina. Tällöin
käytetään prosessiteollisuudessa ja nyttemmin myös
rakennusalalla pohjoismaista käytäntöä
SFS-standardien muodossa. Eri rasitusluokat on selvitetty standardissa
SFS 4596. Metallien korroosio. Ympäristöolosuhteiden luokitus
1980.
|


